
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g.
②装好实验装置.
③检查装置气密性.
④加热,开始反应,直到产生一定量的气体.
⑤停止加热(如图,导管出口高于液面).
⑥测量收集到气体的体积.
⑦准确称量试管和残留物的质量为b g.
⑧测量实验室的温度.
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净.
⑩处理实验数据,求出氧气的摩尔质量.
回答下列问题:
(1)如何检查装置的气密性?
将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气
将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气
.
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积.这三步操作的正确顺序是:
②①③
②①③
(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
慢慢将量筒下移
慢慢将量筒下移
.
(4)如果实验中得到的氧气体积是c L(25℃、1.01×l0
5 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O
2)=
| 22.4L?mol-1×298K×(ag-bg) |
| 273K×cL |
| 22.4L?mol-1×298K×(ag-bg) |
| 273K×cL |
.

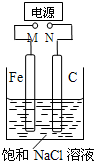 如图,将纯Fe棒和石墨棒插入1L饱和NaCl溶液中.下列说法正确的是( )
如图,将纯Fe棒和石墨棒插入1L饱和NaCl溶液中.下列说法正确的是( ) 计算:
计算: 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下: