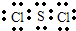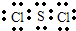x、Y、z、w是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属元素.x原子的最外层电子数与次外层电子数相等,Y原子的最外层电子数与次外层电子数之比为3:1,X与w两原子的最外层电子数之和为9,Z的单质既可与盐酸反应,又能与浓的NaOH溶液反应.据以上信息请回答下列问题.
(1)X的元素符号为:
Be
Be
,W元素在元素周期表中的位置是
第三周期第ⅦA族
第三周期第ⅦA族
w与Y可以按原子个数比1:2形成一种高效安全灭菌消毒剂,其化学式为
ClO2
ClO2
(2)两种非金属元素的气态氢化物中沸点较高是
H2O
H2O
(用化学式填写).
(3)将Z元素的氧化物投入到一定量盐酸中恰好完全反应,向反应后的溶液中逐滴加入氢氧化钠溶液至过量,现象为
先生成白色沉淀,白色沉淀增大到最大值后开始减少,最后完全溶解
先生成白色沉淀,白色沉淀增大到最大值后开始减少,最后完全溶解
(4)以海水中含量最大的物质为原料可以生产w的单质,同时还可以得到另外两种重要的工业原料,该反应的化学方程式为
.