
题目列表(包括答案和解析)
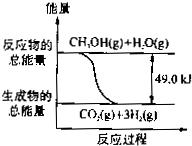 (2012?吉林一模)甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
(2012?吉林一模)甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:.甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+ H2O(g)=CO2 (g) + 3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+ 0.5O2 (g)=CO2 (g) + 2H2(g) △H=-192.9kJ/mol
下列说法正确的是

A.CH3OH的燃烧热是192.9kJ/mol
B.CH3OH转变成H2的过程一定要吸收能量
C.反应①中的能量变化如右图所示
D.根据反应①和②可推知:
2H2(g)+O2 (g)=2H2O (g) △H=-483.8kJ/mol
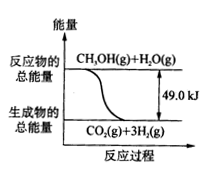
.甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+ H2O(g)=CO2 (g) + 3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+ 0.5O2 (g)=CO2(g) + 2H2(g) △H=-192.9kJ/mol
下列说法正确的是
A.CH3OH的燃烧热是192.9kJ/mol
B.CH3OH转变成H2的过程一定要吸收能量
C.反应①中的能量变化如右图所示
D.根据反应①和②可推知:
2H2(g)+O2(g)=2H2O (g) △H=-483.8kJ/mol
| 1 |
| 2 |
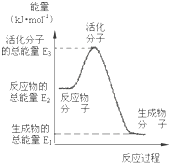 25℃、101kPa时甲醇质子交换膜燃料电池将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1
25℃、101kPa时甲醇质子交换膜燃料电池将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ?mol-1| 1 |
| 2 |
| A、CH3OH的燃烧热△H=-192.9kJ?mol-1 |
| B、反应②的能量变化如图所示,且△H2=E2-E1 |
| C、根据反应②推知:在25℃、101kPa时,1molCH3OH(l)和O2(g)反应生成CO2(g)和H2(g)放出的热量应小于192.9kJ |
| D、2H2(g)+O2(g)=2H2O(g)△H=-483.8kJ?mol-1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com