
题目列表(包括答案和解析)
为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0 g放入30.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(1)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)________________.
供选用试剂:a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.浓氨水
d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案Ⅰ.取672 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g.
方案Ⅱ.向V mL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体a L(标准状况),溶液恰好完全褪色.
方案Ⅲ,取V L(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg.
①其中不合理的方案是________,理由是________.
②选择合理方案的数据计算气体Y中SO2的体积分数(用含未知数的代数式表示)________.
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持装置已省略).

(3)装置A中试剂的作用是________.
(4)简述确认气体Y中含有CO2的实验现象:________.
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?________(填“可靠”或“不可靠”),简述理由:________.
为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]
称取无锈铁钉(碳素钢)12.0 g放入30.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(1)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)________.
(供选用试剂:KSCN溶液,氯水,铁粉,浓氨水,酸性KMnO4溶液.)
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案Ⅰ:取672 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g.
方案Ⅱ:向V mL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色.
方案Ⅲ:取V L(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg.
其中不合理的方案是________,理由是________.
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2
气体.为此设计了下列探究实验装置(图中夹持装置已省略).

(3)装置A中试剂的作用是________.
(4)简述确认气体Y中含有CO2的实验现象:________.
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?________(填“可靠”或“不可靠”),简述理由:________.
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 有毒,具有腐蚀性,易溶于水,二元弱酸. 100℃开始升华,157℃时开始分解. 草酸与浓硫酸混合加热产生CO2、CO和H2O. 草酸钙和草酸氢钙均为白色不溶物 |

| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) |
褪色时间 (S) | ||
| C(mol?L-1) | V(mL) | C(mol?L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
过氧化物在日常生活与工农业生产中应用广泛。如:过氧化氢是一种常见的绿色氧化剂,过氧碳酸钠、过氧化尿素则是多功能、高效、广谱的固体消毒剂。
资料显示:过氧化氢是一种无色液体,属于二元弱酸,能与水、乙醇、乙醚以任意比混溶,易分解,且重金属离子 对其分解过程具有促进催化作用。
(1)写出过氧化氢在Fe3+存在条件下分解的化学反应方程式:____________________;过氧化氢可作为绿
色氧化剂的理由是_______________。
(2)某同学为验证H2O2具有弱酸性,在滴加有酚酞的NaOH稀溶液中,加入适量的H2O2,结果发现溶液的红色褪去。你认为能否通过该实验证明H2O2具有酸性,并说明理由________________。如何通过实验进一步证明褪色的真正原因?请写出具体的实验方法:________________。
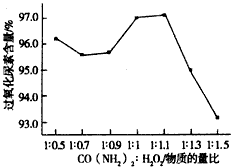
(3)过氧化尿素是一种新型的氧化剂与消毒剂,由H2O2与尿素在30℃反应制得。如图是30℃时过氧化尿素合成过程中原料的物质的量配比对产品含量的影响;你认为实际生产中应将n(H2O2):n[CO(NH2)2]控制在
____________,出现这一实验结果的主要原因是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com