
题目列表(包括答案和解析)
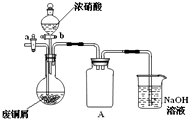 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:下列由相关实验现象所推出的结论正确的是( )
A.C12、SO2均能使滴有酚酞的NaOH溶液褪色,说明二者均有漂白性
B.溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C.镁、铝、NaOH溶液形成原电池时铝做负极,说明铝比镁活泼
D.向溶液中滴加盐酸产生CO2气体,溶液中可能含有CO32-
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- CO32- SO42- HSO4- |
A、e溶液中一定含有HSO
| ||
| B、a溶液中一定含有Al3+ | ||
| C、d溶液中一定有SO42- | ||
| D、c溶液中可能含有CO32- |
| A、原溶液中肯定不含Fe2+、Mg2+、SiO32- | B、步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | C、原溶液中肯定含有K+、Fe2+、NO3-、SO42-、I- | D、为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com