
题目列表(包括答案和解析)
| |||||||||||||||
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:??????????????????????????? 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
 ,得到如下三组数据:
,得到如下三组数据:

①实验1中,以v( H2)表示的平均反应速率为:???? 。
②该反应的正反应为???? (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 ????? (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。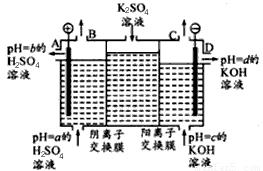
①该电解槽中通过阴离子交换膜的离子数?????? (填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ???????? ?? ;
③电解一段时间后,B出口与C出口产生气体的质量比为?? ????????? 。
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 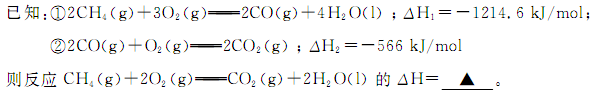
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应: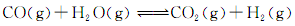 ,得到如下三组数据:
,得到如下三组数据: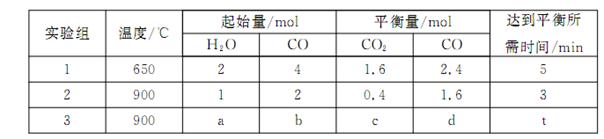
①实验1中,以v( H2)表示的平均反应速率为: 。
②该反应的正反应为 (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。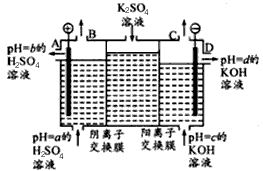
①该电解槽中通过阴离子交换膜的离子数 (填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B出口与C出口产生气体的质量比为 。
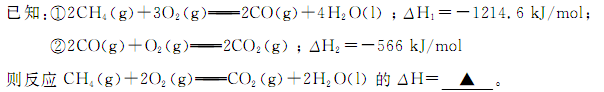
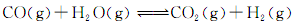 ,得到如下三组数据:
,得到如下三组数据: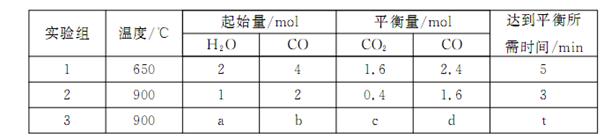

请回答:
(1)Z的最高价氧化物对应水化物w是重要的化工原料,W的化学式为___________________;X2Y2的电子式为_______________________________________________________。
(2)工业上生产W的过程主要分为三个阶段,其核心步骤是氧化阶段,写出该步反应的化学方程式______________________;判断该反应到达化学平衡的标志是____________________。
A.各物质的浓度相等
B.各物质的浓度不再改变
C.各物质的反应速率相等
D.容积固定的容器中,保持温度不变,压强不再改变
(3)在上述氧化的过程中,常采取的措施有:
①温度控制
②增加热交换器的理由是:_________________________________________________________ __________________________________________________________________。
(4)若在反应开始时投入2 mol ZY2和1 mol Y2,反应到达平衡后,体系压强减小30%,则该反应的转化率为_________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com