
题目列表(包括答案和解析)
| 学完中和反应的知识后,某化学兴趣小组的同学在老师的指导下,对酸碱反应过程中,溶液温度变化进行了进一步的探究。请你一起参与。 【提出问题】酸碱反应过程中,溶液的温度是如何变化? 【设计实验方案】室温下,取10份相同体积10%NaOH溶液于10支试管中,分别滴加一定体积10%盐酸,并测定溶液温度的最高值。 【进行实验】依照所设计的实验方案进行实验。记录数据如下: | ||||||
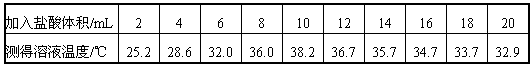 | ||||||
| 【解释与结论】 (1)写出氢氧化钠与盐酸反应的化学方程式_____________。 (2)由溶液温度的变化可知,氢氧化钠与盐酸反应_______(选填“放出”或“吸收”)热量。 (3)从实验记录的数据看,氢氧化钠完全反应时,加入盐酸的体积是在________mL至_______mL之间的某一数值。 【反思与评价】加盐酸的体积在12~20mL之间,溶液温度下降的一种可能原因是____________。 【交流与讨论】结合实验过程记录的数据,任选以下两种情况的一种,用实验证明溶液的酸碱性。 Ⅰ.加入盐酸的体积为4mL时; Ⅱ.加入盐酸的体积为16mL时。你选择的是______(选填“Ⅰ”或“Ⅱ”): | ||||||
|
学习中和反应时,老师和同学们展开了如下探究:
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入NaOH溶液中,并用温度计测量温度变化。
小文发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低。对此合理的解释 ;
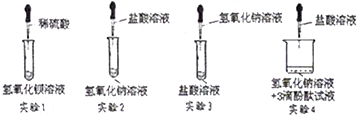
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小苗在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌)。
 |
①通过实验现象,小苗排除了实验B,你认为她的理由是 ;
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是 ;
③实验时,老师告诉小苗:相对于实验A,实验D也有不足。通过下面的资料,你认为理由是 ;
 【资料卡片】:
【资料卡片】:
④小波认为:将NaOH溶液和稀盐酸混合后的溶液蒸干,若得到白色固体,则说明反应生成NaCl,从而确认反应已发生,你认为这种观点是否正确,并说出理由? 。
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:

①实验1所得溶液沸腾时的温度 100℃(填“>”或“<”或“=”);
②实验后溶液一定显碱性的试管有 支,实验3后溶液中NaOH质量分数 (填“>”或“<”或“=”)实验2后溶液中NaOH质量分数;
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识? ;
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是 。
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小岳同学查阅了不同温度下NaOH的溶解度(见资料卡片) ,并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
,并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:

 |
①试剂A是 (填化学式)溶液;
②操作名称:Ⅰ 、Ⅱ 、Ⅲ ;
③为获得纯度较高的NaOH固体,小岳同学应在干燥前将其用 进行淋洗。
【探究五】:测定NaOH样品中NaOH的质量分数
小海取 13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收)。求:
13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收)。求:
①样品中NaOH的质量分数(精确到小数点后一位,3分);
 ②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
解题过程: ;
【交流讨论】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?(1分) ;
【反思提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?(1分) 。
学习中和反应时,老师和同学们展开了如下探究:
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入NaOH溶液中,并用温度计测量温度变化。
小文发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低。对此合理的解释 ▲ ;
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小苗在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌)。

①通过实验现象,小苗排除了实验B,你认为她的理由是 ▲ ;
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是 ▲ ;
③实验时,老师告诉小苗:相对于实验A,实验D也有不足。通过下面的资料,你认为理由是 ▲ ;
 【资料卡片】:
【资料卡片】:
④小波认为:将NaOH溶液和稀盐酸混合后的溶液蒸干,若得到白色固体,则说明反应生成NaCl,从而确认反应已发生,你认为这种观点是否正确,并说出理由? ▲ 。
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:

①实验1所得溶液沸腾时的温度 ▲ 100℃(填“>”或“<”或“=”);
②实验后溶液一定显碱性的试管有 ▲ 支,实验3后溶液中NaOH质量分数 ▲ (填“>”或“<”或“=”)实验2后溶液中NaOH质量分数;
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识? ▲ ;
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是 ▲ 。
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小岳同学查阅了不同温度下NaOH的溶解度(见资料卡片),并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:

 |
①试剂A是 ▲ (填化学式)溶液;
②操作名称:Ⅰ ▲ 、Ⅱ ▲ 、Ⅲ ▲ ;
③为获得纯度较高的NaOH固体,小岳同学应在干燥前将其用 ▲ 进行淋洗。
【探究五】:测定NaOH样品中NaOH的质量分数
小海取13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收)。求:
①样品中NaOH的质量分数(精确到小数点后一位,3分);
 ②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
②在右图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确,1分);
解题过程: ▲ ;
【交流讨论】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?(1分) ▲ ;
【反思提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?(1分) ▲ 。
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(△t)/℃ | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |
在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4·XH2O)。
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2)都会促进其分解。
(2)CuSO4·XH2O可溶于水,在加热时会生成CuSO4和H2O。
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是: 。
(2)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为 。
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
。
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体。晶体采用酒精淋洗的优点是 。
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行热分解,获得相关数据,并绘制成固体质量一温度的关系如图。
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为 色,最终变为黑色;
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为 ;
(3)根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程)
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式: 。
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为 。碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3·Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为 ,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是 (填一种有机物名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com