我们知道氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气
反应方程式为:2Na
2O
2+2CO
2═2Na
2CO
3+O
2(1)你认为用这种方法制氧气的优点是______;
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:
①简述检查装置气密性的方法______;
②向U形管内盛装过量的Na
2O
2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量______;
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应______(填“吸热”或“放热”)同时还可以观察到固体粉末发生变化的现象是______;
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在______mL处.(不考虑实验带来的误差)
(3)Na
2O
2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论.______
变质的程度如何呢?部分同学对“已部分变质的Na
2O
2(含Na
2CO
3)的纯度测定”设计了实验,步骤如下:
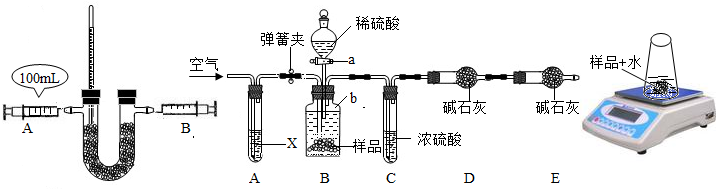
①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w
1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w
2g;⑥根据D装置质量差进行计算.试回答:
i写出盛放稀硫酸的实验仪器名称______;
ii若④⑤两步的实验操作太快,则会导致测定的Na
2O
2的纯度______(填“偏大”或“偏小”).
iii鼓入空气的目的是______,装置A中试剂X应选用______;
ivE装置的作用是______;
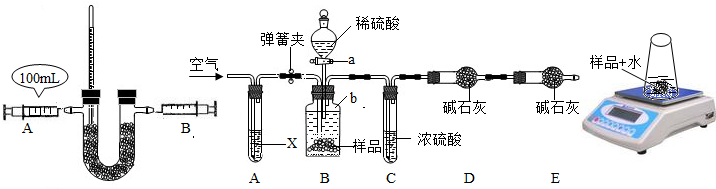
(4)小红同学通过查阅资料了解到Na
2O
2还能与水反应,方程式为:2Na
2O
2+2H
2O═4NaOH+O
2↑于是她根据这一原理设计了另一种测定Na
2O
2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,观察显示数字的变化,并记录(数据见下表);③进行计算.
| 时间/s | 60 | 120 | 180 | 240 | 300 |
| 天平示数/g | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
i从上表数据判断,______秒时,已经反应完全;
ii请你帮小红同学计算此样品中Na
2O
2的纯度,并写出过程.