
题目列表(包括答案和解析)
铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
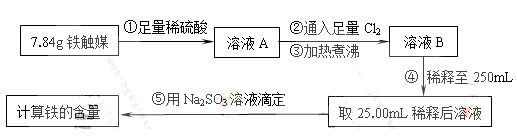
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为 。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
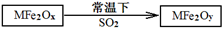
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图。关于此转化过程的叙述不正确的是
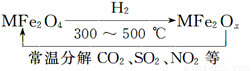
A.MFe2O4在与H2的反应中表现了氧化性
B.MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应
C.MFe2Ox与SO2反应中MFe2Ox被还原
D.若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 ,基态Z原子的核外电子排布式为 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两条)。
(3)ET2的空间构型为 ,为 分子(填“极性”或“非极性”)
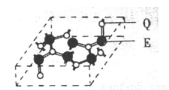
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是 ( )

A.每个晶胞中含有14个心和13个O2-
B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+
C.晶体中与每个K距离最近的K+有8个
D.晶体中,O价氧原子与-2价氧原子的数目比为3:l
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为 。
将总物质的量为m mol的Na2O2和NaHCO3的混合物在密闭容器中加热至2.50℃,使其充分反应,NaHCO3在混合物中的物质的量分数为x。
(1)当x=l/2时,容器中固体产物 (写化学式),其物质的量为 。
(2)若反应后生成的气体为O2和H2O,则x的取值范围 。
(3)当0<x<l/3时,产生气体的物质的量n与x的数学表达式 (写化学式)。
将总物质的量为m mol的Na2O2和NaHCO3的混合物在密闭容器中加热至2.50℃,使其充分反应,NaHCO3在混合物中的物质的量分数为x。
(1)当x=l/2时,容器中固体产物 (写化学式),其物质的量为 。
(2)若反应后生成的气体为O2和H2O,则x的取值范围 。
(3)当0<x<l/3时,产生气体的物质的量n与x的数学表达式 (写化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com