
题目列表(包括答案和解析)
实验室里有一瓶标签残缺的盐酸,请你来共同探究.
(1)
怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是,大家各抒己见.你认为,应该用下述的______方法(填选项编号)立即确认.|
A .讨论 |
B .调查 |
C .实验 |
D .上网 |
具体的做法是
__________________________________________.(2)
粗略测定每毫升该盐酸中含溶质HCl的质量.同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:第
1步:在小烧杯中加入10g5%的NaOH溶液;第
2步:向上述烧杯中滴入2滴酚酞溶液;第
3步:向100mL量筒中注入该盐酸至一定刻度;第
4步:用胶头滴管吸取量筒中的盐酸.逐滴滴入上述烧杯中,直到烧杯中的溶液由红色变为无色为止;第
5步:记录实验数据;第
6步:计算,确定每毫升盐酸中含溶质HCl的质量.请根据以上实验过程,回答下列问题:
①本实验为什么要用指示剂
(酚酞)?答:
_______________________________________________.②第
3步中向量筒注入盐酸,量筒中的液面位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A为8,量筒中盐酸的体积是______mL.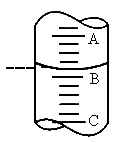
③第
4步要用到玻璃棒,它的作用是______,目的是___________.停止滴入盐酸后,胶头滴管中残留的盐酸应
________________________.④第
5步要记录的实验数据是___________________________________.(3)
测定每毫升该盐酸中含溶质HCl的质量,其原理和方法还有多种,为此大家继续进行探究.你能写出两种其他可行的方法吗?若能,请写在下面(用文字简述所依据的原理和要测定的数据,不需要写出化学方程式).方法一:
_____________________________________方法二:
_____________________________________探究结晶速度影响析出晶体大小.
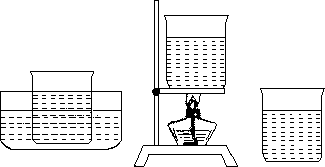
(1)在100mL烧杯中盛有50mL约80℃时的热水,加入硝酸钾固体,不断搅拌,直至加入硝酸钾固体不能再溶解为止;
(2)立即把制得的溶液分别等量地倒入3个烧杯中;
(3)其中一个烧杯立即放入盛有冷水的水槽里冷却,一个烧杯加热蒸发水分,另一个烧杯让它自然冷却,如图所示;
(4)在下表中记录实验现象

①在实验步骤(1)中配制成的溶液是不是80℃时的硝酸钾饱和溶液?
②析出晶体后的溶液是不是饱和溶液?
③要制得较大颗粒的晶体可采用的方法是什么?
 26、请根据题目要求回答下列问题.
26、请根据题目要求回答下列问题.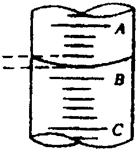
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com