硫酸亚铁铵又称莫尔盐,浅绿色晶体,在空气中比一般的亚铁盐稳定,溶于水但不溶于乙醇,化学式为[(NH
4)
2SO
4?FeSO
4?6H
2O],相对分子质量为392,是常用的分析试剂.在实验室,将FeSO
4和(NH
4)
2SO
4两种溶液按一定比例混合,蒸发浓缩、冷却结晶,很容易得到硫酸亚铁铵晶体.某研究性学习小组已制备得到莫尔盐,准备分析研究他们得到的产品.请你帮助完成部分项目:
(1)预测现象:向盛有莫尔盐溶液的大试管中滴加浓NaOH溶液,并不断振荡.
生成白色沉淀,迅速变成灰绿色,最终变成红褐色;同时放出大量刺激性且能使红色石蕊试纸变蓝得气体
生成白色沉淀,迅速变成灰绿色,最终变成红褐色;同时放出大量刺激性且能使红色石蕊试纸变蓝得气体
.
(2)为了确定产品中亚铁含量,研究小组经查阅资料后,打算用KMnO
4(酸化)溶液滴定莫尔盐溶液中的Fe
2+.离子方程式为:5Fe
2++MnO
4-+8H
+=5Fe
2++Mn
2++4H
2O.滴定时必须选用的仪器有
①④⑤⑥
①④⑤⑥
(从如图所列仪器中选填编号,同种仪器数量不限);滴定时是否需要加加指示剂?
不需要
不需要
.若需要,请指出加什么指示剂;若不需要,请说明理由.
Fe2+完全反应,过量的高锰酸钾将使溶液出现紫色,可指示终点
Fe2+完全反应,过量的高锰酸钾将使溶液出现紫色,可指示终点
.

(3)取莫尔盐产品23.520g,配成250mL溶液,取出25.00mL用0.0500mol/LKMnO
4溶液滴定,消耗KMnO
4溶液19.50mL,则产品中莫尔盐的质量分数
81.3%
81.3%
.


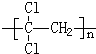 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由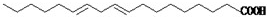 ]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是
]对人体健康是十分有益的,然而,市场上经常会出现价格低廉的植物油,其中的亚油酸含量很低.下列关于亚油酸的说法中不正确的是

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)