
题目列表(包括答案和解析)
| 1 |
| 10000 |
| 1 |
| 10000 |
| ||
| ||
| 催化剂 |
| 高温高压 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |

 2NH3,5min后达到平衡,平衡时氨的体积分数为25%.
2NH3,5min后达到平衡,平衡时氨的体积分数为25%.向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①④⑤
【解析】考查可逆反应的有关计算。这种类型的试题往往采用三段式,即
2A(g)+B(g) 3C(g)
起始量(mol) 2 1 0
转化量(mol) 0.8 0.4 1.2
平衡量(mol) 1.2 0.6 1.2
所以用物质A表示该反应的平均反应速率为
用物质B表示该反应的平均反应速率为
平衡时物质A与B的转化率分别为![]() 、
、
平衡时物质B的浓度为![]()
加入1mol的C就相当于加入2/3molA和1/3molB,因为反应前后体积不变,此时A和B的比值仍然满足2︰1,所以平衡是等效的。
向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g)  3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①④⑤
【解析】考查可逆反应的有关计算。这种类型的试题往往采用三段式,即
2A(g)+B(g)  3C(g)
3C(g)
起始量(mol) 2 1 0
转化量(mol) 0.8 0.4 1.2
平衡量(mol) 1.2 0.6 1.2
所以用物质A表示该反应的平均反应速率为
用物质B表示该反应的平均反应速率为
平衡时物质A与B的转化率分别为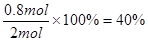 、
、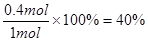
平衡时物质B的浓度为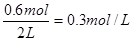
加入1mol的C就相当于加入2/3molA和1/3molB,因为反应前后体积不变,此时A和B的比值仍然满足2︰1,所以平衡是等效的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com