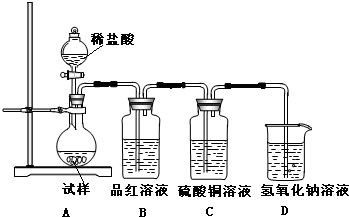
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
(1)若某种固体物质受热发生了分解,下列说法正确的是
D
D
A.充分加热后一定有固体残留
B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化
D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO
3-的物质的量浓度变化趋势为
先逐渐增大,后逐渐减小
先逐渐增大,后逐渐减小
;
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为
2S2-+SO32-+6H+=3S↓+3H2O
2S2-+SO32-+6H+=3S↓+3H2O
;此时在B、C两装置中可能观察到得现象为
B中品红溶液褪色,C中无明显变化
B中品红溶液褪色,C中无明显变化
.
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl
-外,还存在另一种浓度较大的阴离子(X).为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取
搅拌(或加热)
搅拌(或加热)
的措施.以下是检验阴离子(X)的两种实验方案,你认为合理的方案是
乙
乙
(填“甲”或“乙”),请说明另一方案不合理的原因
甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-
甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-
.
方案甲:取少量试样溶液于试管中,先加稀HNO
3,再加BaCl
2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl
2溶液,有白色沉淀生成,证明该离子存在.
(5)写出Na
2SO
3固体加热到600℃以上分解的化学方程式
.


 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题: