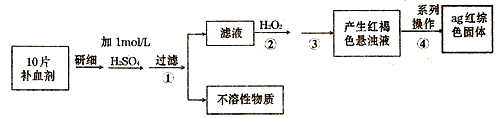
三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl
3?6H
2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO
3分解,再降温结晶得FeCl
3?6H
2O晶体.填写下列空白:

(1)收集导管B处的气体可采用的方法是
用排水法或向下排空气法
用排水法或向下排空气法
.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是
因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快
因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快
.
(2)烧杯内放过量稀HNO
3的原因是
稀HNO3有强氧化性,为保证使Fe2+ 全部氧化成Fe3+
稀HNO3有强氧化性,为保证使Fe2+ 全部氧化成Fe3+
.发生反应的离子方程式是
3 Fe2++4H++NO3-═3 Fe3++NO↑+2H2O
3 Fe2++4H++NO3-═3 Fe3++NO↑+2H2O
.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是
与大气相通,使分液漏斗中的酸可滴入A中
与大气相通,使分液漏斗中的酸可滴入A中
.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl
3?6H
2O,而不用直接蒸干的方法来制得晶体的理由是
因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O
因为FeCl3是强酸弱碱盐水解:FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O
(5)你认为该实验存在的缺点可能有:
反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3?6H2O不纯
反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3?6H2O不纯
.


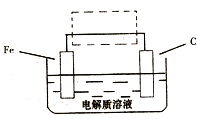 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题: