
(2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题:
(1)元素C在周期表中的位置是
第二周期第ⅤA族
第二周期第ⅤA族
.A与B形成最简单的有机物M中含有化学键类型是
极性键
极性键
;A与B形成的水果储熟剂的电子式为
.
(2)用离子方程式表示X的水溶液pH<7的原因
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.
(3)Y遇水发生反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.
(4)E与F形成化合物Z,M与F单质按体积比1:1混合,按右图装置所示实验,光照片刻后,可观察到的现象有倒置量筒中气体颜色逐渐变浅,有少量白雾,内壁出现油状液滴,
量筒内液面上升
量筒内液面上升
,
水槽中有晶体析出
水槽中有晶体析出
.
(5)A、B、D可形成有机物N,Mr(N)=46,N的同分异构体有两种:N'和N''.N'的核磁共振氢谱有1个峰,N'燃烧热为1455kJ/mol;N''燃烧热为1367kJ/mol.试写出N'燃烧热的热化学方程式:
CH3OCH3(1)+3O2(g)═2CO2(g)+3H2O(1)△H=-1455kJ/mol
CH3OCH3(1)+3O2(g)═2CO2(g)+3H2O(1)△H=-1455kJ/mol
.

 (2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题:
(2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题:

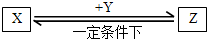
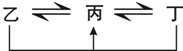 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: