
题目列表(包括答案和解析)
实验室可用NaBr、浓硫酸、乙醇为原料制备溴乙
烷,已知反应物的用量:0.3molNaBr(s);0.25mol
C2H5OH(乙醇);36mL浓硫酸(溶质分数为98%,密
度1.84g/cm3);25mLH2O,其中乙醇的密度为
0.80g/cm3,回答下列问题:
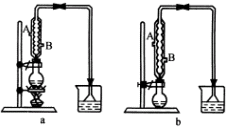
(1)该实验应选择图中的a还是b装置?__________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
[ ]
|
A.50mL |
B.100mL |
|
C.150mL |
D.250mL |
(3)冷凝管中的冷凝水的流向应是________
|
A.A进B出 |
B.B进A出 |
|
C.从A进或B进均可 |
(4)由NaBr、浓硫酸和乙醇共热制备C2H5Br反应的化学方程式为________;
可能发生的副反应为:________。
(5)上述反应完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是________,必须使用的仪器是________。
(7)本实验的产率为60%,则可制取溴乙烷________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是________。

(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷,已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质分数为98%,密度1.84g×mL-1);25mL水,其中乙醇的密度为0.80g×cm-3,回答下列问题。
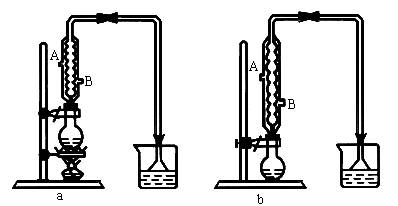
(1)该实验应选择图中的a还是b装置?
___________________________________________________
(2)反应装置中的烧瓶应选择下列哪种规格最合适?
__________________________
A.50 mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是_____________。
A.A进B出 B.B进A出 C.从A进或B进均可
(4)由NaBr浓H2SO4和乙醇共热制备C2H5Br反应的化学方程式为_________________
________________。可能发生的副反应为:_____________________________________。
(5)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有_____________________________________________________________。
(6)从棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是__________________,必须使用的仪器是_______________________________。
(7)本实验的产率为60%,则可制取溴乙烷______________g。
(8)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏。为证明最终得到的产品一溴乙烷中含有溴元素,可采取的实验方法是_____________________________
__________________________________________________。
某实验小组欲测定KMnO4的分解率α,但加热前忘记称量KMnO4的质量。面对此情况,甲同学采用下述方法:在加热时,利用浓盐酸与KMnO4受热部分分解后所得的固体混合物反应产生的Cl2被碱石灰吸收,通过碱石灰增重来计算KMnO4的分解率α。(与热的浓盐酸反应时,固体混合物中的Mn元素均被还原成Mn2+)

取KMnO4受热部分分解后所得的固体混合物mg进行实验,请从k@s^5*u上图中选用所需的仪器(可重复选用)组成一套反应装置,其它固、液试剂自选。(其中某些连接和固定仪器用的
玻璃管、胶管、铁夹、铁架台及加热装置、打气筒等均略去)
(1)在反应发生前,为了消除装置内空气中酸性气体的影响,须用打气筒向装置内鼓入一定量的空气。请你在下表中填写完成本实验时各装置的连接次序及药品。
| 各装置连接次序 | A | C | C | |||
| 对应的药品 | d:浓盐酸 e:固体混合物 | 碱石灰 | 碱石灰 |
(2)k@s^5*u上述高锰酸钾受热部分分解后所得固体混合物中K2MnO4与MnO2物质的量之比是 。
(3)当A装置内反应结束后,关闭分液漏斗活塞,打开止水夹k,再一次用打气筒向装置内鼓入一定量空气,其目的是 。
(4)若测得碱石灰增重ng。为了计算KMnO4的分解率α,该同学采用方法如下:设原mg的固体混合物中KMnO4及MnO2的物质的量分别为x、y,依据实验数据m及n,可列出三个含x、y、α的等式,请你写出这三个等式。(注意:等式中不用带单位)
仅含m、x、y的等式①:m= 。
仅含 n、x、y的等式②:n= 。
仅含α、x、y的等式③:α= 。
(5)另一同学设计更为简单的方法(无须化学反应)也可测定KMnO4的分解率α。
该同学的方法是:称取一定量KMnO4受热部分分解后所得的固体混合物,置于盛有适量蒸馏水的烧杯中,充分搅拌,再进行“一系列实验操作”并记录实验数据,最后经计算,即可得出KMnO4的分解率α。该同学的“一系列实验操作”是指 。
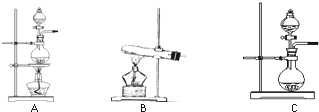
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | ______ |
| ② | 制氨气 | NH4Cl→NH3 | ______ |
| ③ | 制氯气 | HCl→Cl2 | ______ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com