
题目列表(包括答案和解析)

如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题: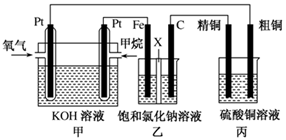
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。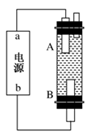
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com