
题目列表(包括答案和解析)
| A、原白色固体一定是(NH4)2CO3 | B、无法确定原白色固体的成份 | C、原白色固体中不含任何金属离子 | D、原白色固体一定是(NH4)2CO3和NH4HCO3的混合物 |
取某白色固体少量于试管中加热,固体逐渐消失,生成水蒸气和其它两种气体,试管内除管口有少量水珠外,无任何残留物。另取该固体1.40g与过量烧碱液混合加热,生成一种使湿润红色石蕊试纸变蓝的气体,这些气体正好和120.0 mL,0.100 mol/L,H2SO4完全反应;再取该固体1.40 g跟足量盐酸反应,放出一种无色无臭的气体,这些气体通入过量的澄清石灰水中,得到1.60 g白色沉淀。下列说法正确的是
A.原白色固体一定是(NH4)2CO3
B.无法确定原白色固体的成份
C.原白色固体中不含任何金属离子
D.原白色固体一定是(NH4)2CO3和NH4HCO3的混合物
某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜.制备方法如下:
方法一:铜与浓硫酸反应
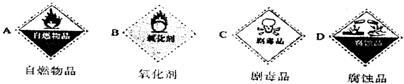
(1)浓硫酸试剂瓶上适合贴上的标签是________(可多选).

(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色固体.甲同学为了验证其中白色固体的主要成分.设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象:________;实验结论:所得白色固体的化学式为________.
(3)甲还观察到加热时,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失.淡黄色固体消失的原因是(用化学反应方程式回答)________.
方法二:
(4)乙同学认为甲设计的实验方案不好,他自己设计的思路是:
2Cu+O2 2CuO,CuO+H2SO4
2CuO,CuO+H2SO4 CuSO4+H2O.对比甲的方案,你认为乙同学设计的实验方案的优点是________.
CuSO4+H2O.对比甲的方案,你认为乙同学设计的实验方案的优点是________.
方法三:
(5)丙同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色.
写出反应的化学反应方程式________.
方法四:
(6)请你再帮助该实验小组的同学设计一种只用铜和稀硫酸为原料制取硫酸铜的方法,写出该方方法中的化学反应方程式:________.
| ||

| ||
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com