
题目列表(包括答案和解析)
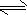 N2H5++OH-
N2H5++OH-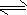 N2H62++OH-
N2H62++OH-  N2H4+H3O+
N2H4+H3O+ 在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式 肼______ ___,过氧化氢______ ____。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是_____________________ _________。
(3)写出肼和双氧水反应的热化学方程式_____________________________。
(4)已知H2O(l)==H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是_________________。
(5)已知N2(g) + 2O2(g) == 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) == N2(g)+2H2O(g);△H= ―534KJ/mol,
则肼与NO2完全反应的热化学方程式为_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com