
题目列表(包括答案和解析)
某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1 L.测得部分实验数据如下表:
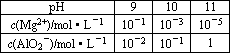
试回答:
(1)若向混合溶液中加入NaOH溶液至pH=9,请用所给的实验数据判断,有否Mg(OH)2沉淀出现________(填“能”或“否”),由此你得到的初步结论是________.
(2)若向混合溶液中加入NaOH溶液至pH=10,请写出反应各阶段所发生反应的离子方程式________,________,________,________,那么,所加入的NaOH溶液中溶质的的物质的量为________.
下列溶液中,c(H+)由小到大的排列顺序是________
①0.1 mol/L HCl溶液
②0.1 mol/L H2SO4溶液
③0.1 mol/L NaOH溶液
④0.1 mol/L CH3COOH溶液
|
下列判断正确的是 | |
| [ ] | |
A. |
0.1 mol·L-1的盐酸和0.1 mol/L的醋酸分别与2 mol·L-1 NaOH反应的速率相同 |
B. |
0.1 mol/L HCl和0.1 mol/L HNO3分别与大小相同的大理石反应的速率相同 |
C. |
Mg和Fe与0.1 mol·L-1 HCL反应速率相同 |
D. |
大理石与大理石粉分别与0.1 mol·L-1 HCl反应的速率相同 |
| |||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com