
题目列表(包括答案和解析)
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸转化变成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 假设②:该混合金属粉末中除镁外还含有 假设③:该混合金属粉末中除镁外还含有铝、锌. ●实验探究: 甲同学基于假设③设计实验方案: 操作Ⅰ是在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加足量的稀氨水,请回答:  乙同学基于假设③设计另一方案:  (2)沉淀A、B、D的化学式:A (3)甲同学用样品和稀硫酸反应所得溶液含有较多H+、Mg2+、Al3+、SO42-,向其中滴入NaOH溶液,生成沉淀的量与加入NaOH溶液体积关系可能正确的是  (4)乙同学方案的操作②中,铝与NaOH溶液反应的化学方程式为 操作②与操作③中都加了NaOH溶液,但其用量差别是 (5)丙同学通过分析对比,认为乙的方案比甲同学的好,其理由可能是 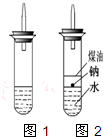 某实验小组对中学课本中已经学过的生成氢气的反应进行了研究,写出了如下三个可生成氢气的反应: 某实验小组对中学课本中已经学过的生成氢气的反应进行了研究,写出了如下三个可生成氢气的反应:A、锌与稀盐酸反应;B、钠与水反应;C、铝与NaOH溶液反应. 请回答下列问题: (1)写出A与C的离子方程式:A: (2)为了点燃上述三个反应生成的氢气,他们设计了如图1所示的实验装置,结果是A、C获得了成功,而B却失败了. ①点燃氢气前,必须进行的操作是 ②他们认为B实验不能点燃的原因有二:一是钠与水反应太快,二是钠的用量太少.于是他们准备增加钠用量再做实验.可老师说这样太危险.你认为产生危险的原因是 (3)实验小组查阅钠、煤油、水的密度分别为0.97g?cm-3、0.89g?cm-3、1.00g?cm-3,并据此对实验B进行了改进(如图2).在改进后的实验中H2的生成速度 铝是一种重要的金属。 (1)铝在元素周期表中的位置是__________。 (2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为__________________________。 (3)铝与NaOH溶液反应的离子方程式为____________________________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中加入等质量的Al,产生气体的体积比为5∶6,则所加Al的质量为__________。 (4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________________________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) ______________________。 铝是一种重要的金属。 (1)铝在元素周期表中的位置是 。 (2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为 。 (3)铝与NaOH溶液反应的离子方程式为 ;同温同压下,在浓度和体积均为100mL 2mol/L的盐酸及NaOH溶液中各加入等质量和Al,产生气体的体积比为5:6,则所加Al的质量为 。 (4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3?6H2O晶体,主要操作包括 ,在干燥的HCl气流中加热AlCl3?6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) 。 铝是一种重要的金属. (1)铝在元素周期表中的位置是________. (2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为________. (3)铝与NaOH溶液反应的离子方程式为________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中各加入等质量和Al,产生气体的体积比为5∶6,则所加Al的质量为________. (4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明)________. 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |