.联氨(N
2H
4)及其衍生物是一类重要的火箭燃料.N
2H
4与N
2O
4反应能放出大量的热.
(1)已知:2NO
2(g)?N
2O
4(g),N
2O
4为无色气体.
①在上述条件下反应能够自发进行,则反应的△H
<
<
0(填写“>”、“<”、“=”)
②一定温度下,在密闭容器中反应2NO
2(g)?N
2O
4(g)达到平衡,达到平衡状态的标志
ACE
ACE
.
A单位时间内生成n mol N
2O
4的同时生成2nmolNO
2B用NO
2、N
2O
4的物质的量浓度变化表示的反应速率之比为2:1的状态
C混合气体的颜色不再改变的状态
D混合气体的密度不再改变的状态
E混合气体的平均相对分子质量不再改变的状态
③其他条件不变时,下列措施能提高NO
2转化率的是
BC
BC
(填字母)
A 减小NO
2的浓度 B 降低温度 C 增大压强 D 升高温度
④17℃、1.01×10
5Pa,往10L密闭容器中充入NO
2,达到平衡时,c(NO
2)=0.2mol?L
-1、c(N
2O
4)=0.16mol?L
-1.请计算反应初始时,充入NO
2的物质的量;请计算该温度下该反应的平衡常数K;请计算该温度下反应N
2O
4(g)?2NO
2(g)的平衡常数K.(请写出计算过程)
(2)25℃时,1molN
2H
4(l)与足量N
2O
4(l)完全反应生成N
2(g)和H
2O(l),放出612.5kJ的热量.
请写出该反应的化学方程式:
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225KJ/mol
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225KJ/mol
.

 Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是
Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是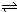 N2O4(g)达到平衡.
N2O4(g)达到平衡. N2O4(g)的平衡常数K.
N2O4(g)的平衡常数K.