
题目列表(包括答案和解析)

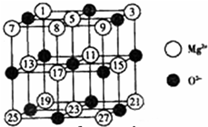 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
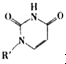 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: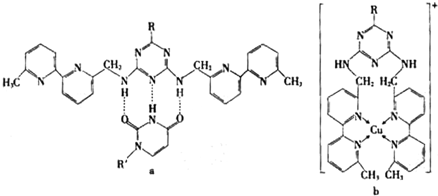
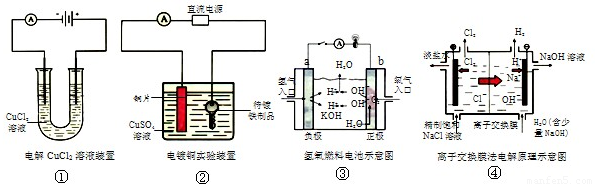
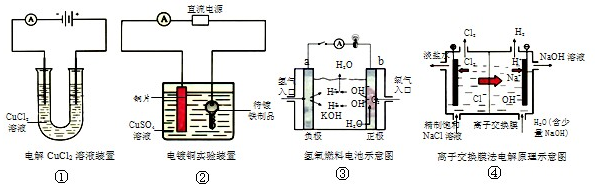
| A.装置①中正极反应式为:2Cl--2e-=Cl2,负极反应式为:Cu2++2e-=Cu |
| B.装置②中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g |
| C.装置③中b极为正极,该极的电极反应方程式为O2+2H2O+4e-=4OH- |
| D.装置④阴极的纯水中加入NaOH的作用是:增大离子浓度,增强溶液的导电性 |
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
(1)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入________(写化学式).
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去).请根据图中信息写出t1时刻前该反应的离子方程式________.t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是________.

(3)该课题组对影响脱氮速率的因素提出了如下假设:
假设一:溶液的pH;
假设二:温度;
假设三:铁粉颗粒大小;…….
请你设计实验验证上述假设一,写出实验步骤及结论.(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验步骤及结论:________.
(4)氮的氧化物是造成大气污染的重要原因之一,氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3 5N2+6H2O 6NO2+8NH3
5N2+6H2O 6NO2+8NH3 7N2+12H2O
7N2+12H2O
NO
与NO2混合气体180 mol被8.90×103 g氨水(质量分数0.300)完全吸收,产生156 mol氮气.吸收后氨水密度为0.980 g/cm3.计算:①该混合气体中NO与NO2的体积比.
②吸收后氨水的物质的量浓度(答案保留1位小数)________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com