
题目列表(包括答案和解析)

| ||
| ||
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
| 主要成分(mg/L): 碳酸氢根(HCO3-):173-205 氯离子(Cl-):1.0-8.0 硫酸根(SO42-):16.08-19.52 钠离子(Na+):8-50 镁离子(Mg2+):2.5-12.5 PH值:7.8±0.5 |
 Na2C03+H20+C02↑
Na2C03+H20+C02↑
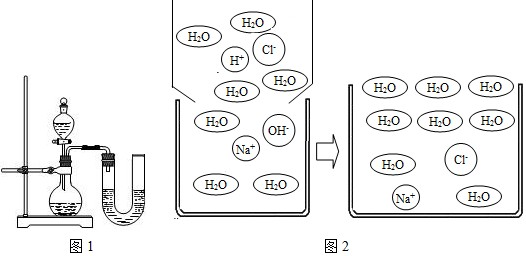
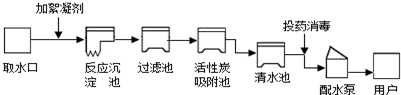
| 主要成分(mg/L): 碳酸氢根(HCO3-):173-205 氯离子(Cl-):1.0-8.0 硫酸根(SO42-):16.08-19.52 钠离子(Na+):8-50 镁离子(Mg2+):2.5-12.5 PH值:7.8±0.5①“SO42-”中数字“2”的含义是 每个硫酸根离子带两个单位的负电荷 每个硫酸根离子带两个单位的负电荷 .②该矿泉水显 碱 碱 性(填“酸”、“碱”或“中”).③日常生活中用 肥皂水 肥皂水 区别软水和硬水,可通过煮沸 煮沸 方法降低水的硬度.(5)今年5月20日是第23个“中国学生营养日”,主题是:“全面、均衡、适量--培养健康的饮食行为”.请你用所学的化学知识关注同学们的营养问题. 我市某学校的学生食堂午餐提供的食谱为:大米饭、豆腐干炒肉、骨头蛋汤. ①以上食物中为我们提供的营养素有糖类、 蛋白质 蛋白质 ,油脂、无机盐和水.②考虑到中学生身体发育对各种营养素的需要,你认为食堂还应增加的一种食物是 B B ;(填编号).A.红烧肉 B.青菜 C.红烧鱼块 D.油炸馒头. ③下列说法正确的是 B B A.大量使用食品添加剂,不会对人体造成伤害 B.幼儿及青少年缺钙会得佝偻病 C.出售海产品时,为了延长保鲜期可以用甲醛溶液浸泡 D.霉变的大米经过淘洗可放心食用. ④食堂常使用铁强化酱油,酱油中加铁强化剂是为了防止-- (6)我国化工专家侯德榜探索发明的“侯氏制碱法”,其生产过程涉及的主要化学反应如下: ①NH3+C02+X=NH4HC03 ②NH4HC03+NaCI═NH4Cl+NaHC03↓ ③2NaHC03
请回答: (1)反应①中X的化学式为 H20 H20 ;(2)NH4Cl中N元素的化合价为 -3 -3 价;(3)除去混在Na2C03粉末中少量的NaHC03的方法是 加热混合物 加热混合物 .
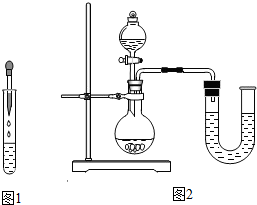 (2012?沐川县二模)在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合. (2012?沐川县二模)在一节化学课上,一个精彩的实验探究正在进行:张老师向一支试管中加入氢氧化钠溶液,再逐渐滴加稀盐酸,振荡,使其充分混合.[提出问题]氢氧化钠溶液和盐酸混合在一起后,我们并没有观察到明显变化,它们到底发生反应没有呢? [猜想交流]①二者没发生反应;②二者反应了. [设计方案]方案一:借助酚酞、石蕊的变色来验证 方案二:通过测溶液的pH值来验证 方案三:利用中和反应是放热反应来验证 [实验探究] 方案一:甲组同学按图1所示的方法,先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞溶液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,看到 红色逐渐消失 红色逐渐消失 ,证明二者发生了反应.请指出右图操作中的错误:胶头滴管伸入到试管中去 胶头滴管伸入到试管中去 .乙组同学向氢氧化钠溶液和盐酸的混合溶液中滴加紫色石蕊溶液,观察到溶液显红色.该组实验能否证明二者发生了反应?说明理由. 不能;因为如果盐酸过量,也能使石蕊溶液变红 不能;因为如果盐酸过量,也能使石蕊溶液变红 .方案二:丙组同学先测出氢氧化钠溶液的pH值,然后在滴加稀盐酸的过程中,不断测出混合溶液的pH值,发现混合溶液的pH值在不断 减小 减小 ,体现出碱性由强到弱,变成中性,直至显酸性的过程.证明二者发生了反应.若在滴入稀盐酸的过程中,观察到有少量气泡出现,则产生气泡的原因可能是可能是氢氧化钠吸收空气中的二氧化碳而变质 可能是氢氧化钠吸收空气中的二氧化碳而变质 .方案三:丁组同学在没使用温度计的情况下,通过图2装置完成了实验验证.则U形管中液面的变化情况 是 左低右高 左低右高 .你认为最合理的解释是中和反应放出的热使烧瓶内气体体积膨胀,压强增大 中和反应放出的热使烧瓶内气体体积膨胀,压强增大 .同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |