
题目列表(包括答案和解析)
| ||
| ||
| ||
| ||
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)在接触室中生成SO3的反应条件的选择,可以完全用勒夏特列原理解释的是 。?
A.用V2O5作催化剂? B.温度为400~500 ℃? C.常压? D.O2过量?
(2)在硫酸工业的尾气中, 是主要的大气污染物,必须进行净化处理,处理方法可采用过量氨水吸收,反应的离子方程式是 。?
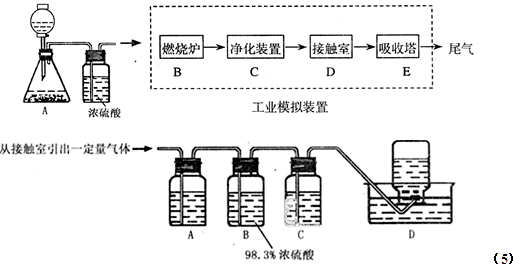
(3)下图是工业制取硫酸的三个主要设备,写出A装置的名称 ;写出B中发生的反应的化学方程式: 。?

(4)现有含FeS272%的黄铁矿100吨,如果在煅烧的过程中,FeS2损失了10%,则可生成质量分数为98%的硫酸 吨。?
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2→ 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3 + 4 SO2
含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
(1)我国目前多用煅烧黄铁矿的方法来制备二氧化硫,该反应的化学方程式为___________
________________________________,该反应常在______________________(填写设备名称)内进行。

(2)现有A、B、C、D四地的地理位置如图所示,交通均较为便利,其他地理条件如下:A地是风景旅游城市;B地是硫酸消费中心;C地有较为丰实的黄铁矿资源;D地有少量的硫酸消费。则硫酸工厂厂址应选择在___________地。
(3)如果某厂生产98%的浓硫酸100 t,在生产过程中硫的总损耗率为2%,则需要含FeS260%的黄铁矿____________t。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com