
题目列表(包括答案和解析)
(1)已知某混合气体的体积百分组成为80.0%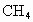 、15.0%
、15.0%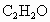 .请计算0.500mol该混合气体的质量和标准状况下的密度(g/L).
.请计算0.500mol该混合气体的质量和标准状况下的密度(g/L).
(2)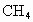 在一定条件下催化氧化可以生成
在一定条件下催化氧化可以生成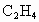 、
、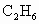 (水和其他产物忽略不计).取一定量
(水和其他产物忽略不计).取一定量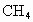 经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780g/L.已知反应中
经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780g/L.已知反应中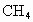 消耗了20.0%,计算混合气体中
消耗了20.0%,计算混合气体中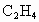 的体积百分含量.(本题计算过程中请保留3位有效数字)
的体积百分含量.(本题计算过程中请保留3位有效数字)
下列情况中说明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是________.
H2(g)+I2(g)已达平衡状态的是________.
①单位时间内生成n mol H2的同时,生成n mol HI;
②1个H-H键断裂的同时有2个H-I键断裂;
③混合气中百分组成为HI%=I2%;
④反应速率v(H2)=v(I2)=![]() v(HI)时;
v(HI)时;
⑤混合气体中c(HI)∶c(H2)∶c(I2)=2∶1∶1时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化.
上述⑥~⑩的说法中能说明2NO2![]() N2O4达到平衡状态的是________;⑩项能否说明A(g)+B(l)
N2O4达到平衡状态的是________;⑩项能否说明A(g)+B(l)![]() C(g)达到平衡状态________.
C(g)达到平衡状态________.
(1)已知某混合气体的体积百分组成为80.0%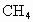 、15.0%
、15.0%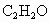 .请计算0.500mol该混合气体的质量和标准状况下的密度(g/L).
.请计算0.500mol该混合气体的质量和标准状况下的密度(g/L).
(2)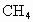 在一定条件下催化氧化可以生成
在一定条件下催化氧化可以生成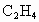 、
、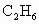 (水和其他产物忽略不计).取一定量
(水和其他产物忽略不计).取一定量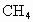 经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780g/L.已知反应中
经催化氧化后得到一种混合气体,它在标准状况下的密度为0.780g/L.已知反应中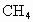 消耗了20.0%,计算混合气体中
消耗了20.0%,计算混合气体中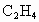 的体积百分含量.(本题计算过程中请保留3位有效数字)
的体积百分含量.(本题计算过程中请保留3位有效数字)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com