
题目列表(包括答案和解析)
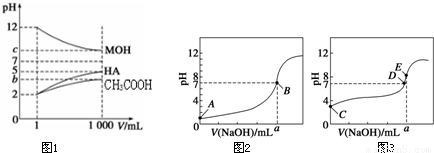
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:

(1)HA为________酸,HB为________酸(填“强”或“弱”)。
(2)若c=9:则
①稀释前HB溶液和MOH溶液等体积混合后,溶液中c(B-) ________c(M+) (填“>”或“<”或“=”)。
②稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为_______________________________________________ (用酸、碱的化学式表示)。
③将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为________(填“大于”“小于”或“等于”)。
(3)若b+c=14,则MOH为________碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH________7(填“大于”“小于”或“等于”)。
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5 ,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
以海水中常见物质NaCl为原料可以发展很多种工业,
(1)写出电解饱和食盐水的化学方程式______________________。
(2)以氯碱工业中的某些物质为原料制取漂白粉的化学方程式是_______________________
(3)从海水中获取的食盐中通常含有少量的MgCl2、Na2SO4等杂质,现采取下列方案将其提纯,其合理的操作顺序是__________________________________[来源:]
①取一定量的食盐晶体溶于水 ②加入过量的NaOH溶液 ③加入过量的BaCl2溶液
④过滤 ⑤蒸发溶液 ⑥加入过量的Na2CO3溶液 ⑦加入适量的盐酸,调节溶液的pH
Ⅱ:2007年11月18日凌晨乌克兰一煤矿因瓦斯爆炸而发生矿难,死亡人数超过100人;2007年12月12日,河南省某煤矿因发生煤矿瓦斯突发事故而导致12名矿工遇难.瓦斯是CH4和CO混合而成的有毒气体,遇到明火极易发生爆炸
(4)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比
(5)已知在101kPa时,CO的燃烧热为283kJ/mol,相同条件下若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.3倍,写出CH4完全燃烧的热化学方程式
120℃,101kPa下,a ml由CO、CH4组成的混合气体在bmlO2中完全燃烧后,恢复到原温度和压强
(6)若混合气体和O2恰好完全反应,产生bmlCO2,则混合气体中CH4的体积分数为
(7)若燃烧后气体体积缩小了a/4ml,写出a与b必须满足的关系式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com