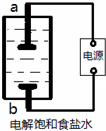
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO
3.②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO
3氧化.
(1)该小组利用如右图所示装置制取家用消毒液(主要成分为NaClO),a得到了氢气,则a为
阴极
阴极
(填“阳极”或“阴极”).生成NaClO的离子方程式为
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.
(2)该小组将0.784L(标准状况)Cl
2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL.
①取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液.用0.2000mol?L
-1 Na
2S
2O
3溶液滴定:I
2+2S
2O
32-═2I
-+S
4O
62-,消耗Na
2S
2O
3溶液10.00mL时恰好到达终点.
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na
2S
2O
3溶液滴定到终点,需Na
2S
2O
3溶液30.00mL.
①操作②中氯酸钠与碘化钾反应的离子方程式为
ClO3-+6I-+6H+═3I2+Cl-+3H2O
ClO3-+6I-+6H+═3I2+Cl-+3H2O
.
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为
1:1
1:1
.
③计算氢氧化钠溶液的物质的量浓度.

 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:



 中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题.
中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去).请回答下列有关问题.