
题目列表(包括答案和解析)
 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O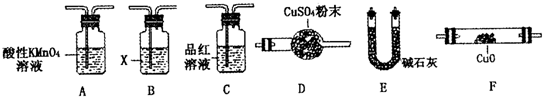
 工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 溶液紫红色褪去 |
含有Fe2+ 含有Fe2+ |
| 步骤②: 另取少量所得溶液,滴加KI和淀粉溶液 另取少量所得溶液,滴加KI和淀粉溶液 |
溶液变为蓝色 溶液变为蓝色 |
含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变;试管中收集到气体 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变;试管中收集到气体 |
含有两种或以上气体 |


| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com