
题目列表(包括答案和解析)
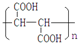
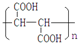







| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 4 |
| 27 |
| 4 |
| 27 |
| Cl2 |
| 催化剂 |

| ①NaCN |
| ②H2O,H+ |

| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


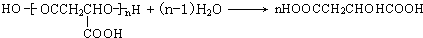
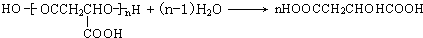
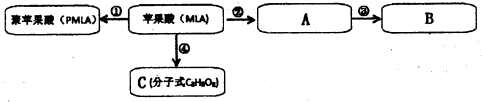
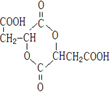
(12分)某芳香族化合物A的结构简式是 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。
(1)E的分子式是 。
(2)关于上述各步转化中,下列说法正确的是 。
a. 以上各步没有涉及加成反应 b. E比C的相对分子质量小18
c. A、B、C、D中都含有—COOH
d . A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
(3)写出所有符合下列要求的E的同分异构体的结构简式:
(①分子中苯环上有三个取代基,且苯环上的一氯代物有两种②1 mol该有机物与足量银氨溶液反应能产生4 mol Ag)。
(4)针对以下不同情况分别回答:
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
(10分)榴石矿石可以看作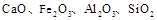 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
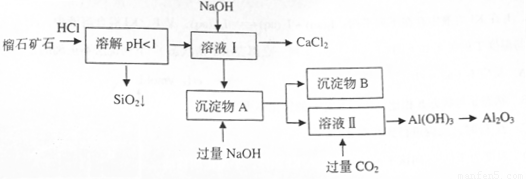
(1)榴石矿加盐酸溶解后,溶液里除了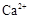 外,还含有的金属离子是
。
外,还含有的金属离子是
。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致 溶解, 沉淀。

(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式 。
(4)①某同学在实验室中用图I装置制取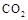 气体并通入溶液II中,结果没有沉淀产生,可能的原是
;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为
。
气体并通入溶液II中,结果没有沉淀产生,可能的原是
;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为
。
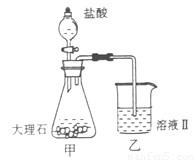
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com