
题目列表(包括答案和解析)
| ||
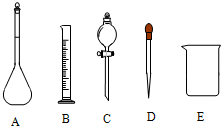 某环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
某环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成250mL0.1mol?L-1的盐酸溶液.
(12分)(1)现有73g某双原子分子气体,它的摩尔质量为36.5 g·mol—1。则:
① 该气体的物质的量为 mol。
② 该气体所含原子数为 NA。
③ 该气体在标况下的体积为 L。
④该气体完全溶于500mL水后稀释到2L,物质的量浓度为 mol·L—1。
(2)将100mL 0.5mol/L Na2SO4溶液加水稀释到500mL,稀释后:c(Na+)= mol·L—1。
(3) g H2O中的O原子数目与标准状况下2.24LCO2中的O原子数目相同。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com