
题目列表(包括答案和解析)
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
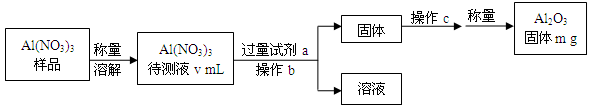
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
|
物质 |
Na |
S |
Al2O3 |
|
熔点/℃ |
97.8 |
115 |
2050 |
|
沸点/℃ |
892 |
444.6 |
2980 |
a.100℃以下 b.100℃~300℃ c. 300℃~350℃ d. 350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx = 2Na + xS(3<x<5),则阳极的电极反应式为 。
X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.Y、Z两元素的简单离子的半径Y>Z
B.Y元素最高价氧化物对应水化物的化学式为H2YO4
C.原子序数由小到大的顺序为W<X<Y<Z
D.X与W可以形成W2X、W2X2两种化合物
(15分)
有E、Q、T、x、z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态E原子占有三个能级且每个能级中电子数目相等,基态Q原子的2p轨道处于半充满状态,X为周期表中前四周期电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)氢元素和E、Q两种元素形成分子式为HEQ的化合物,HEQ分子属于 分子(填“极性”或“非极性”),分子中有 个σ键。
(2)与分子式为ET互为等电子体的离子是 (写出一种即可)。基态Z原子的核外电子排布式____。
(3)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两种)。
(4)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为 。甲与E的最高价氧化物反应的方程式为 。
(5)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为 ;②乙的晶体中Q元素原子的杂化方式为 。
铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
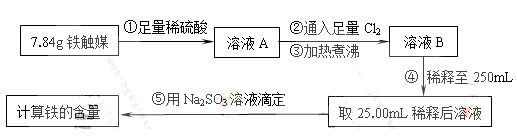
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸 mL
(2)步骤②通入Cl2的目的是 (用离子方程式表示)
(3)步骤④后需用 (填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为 。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式 ,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的 作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
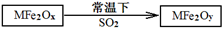
则可以判断x y,氧化性:MFe2Oy SO2(填“>”、“<”或“=”)
X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式为H2YO4
B.原子半径由小到大的顺序为:W<X<Z<Y
C.X与W可以形成W2X、W2X2两种化合物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物稳定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com