
题目列表(包括答案和解析)
| 2 |
| 3 |
| 2 |
| 3 |
| 1.9-x |
| 2.8-2x |
| 1.9 |
| 2.8 |
| x |
| 28(2.8-2x) |
| x |
| 28(2.8-2x) |
| 1.9-x |
| 2.8-2x |
| 1.9 |
| 2.8 |
| x |
| 28(2.8-2x) |
| x |
| 28(2.8-2x) |
某化学反应2A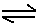 B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
|
实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟内平均速率为 。
(2)在实验2中,A的初始浓度c2=______ ____,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是______ ____。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”、“=”或“<”),且c3__________1.0mol·L-1(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。
某化学反应2A![]() B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20分钟内平均速率为 。
(2)在实验2中,A的初始浓度c2=______ ____,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是______ ____。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”、“=”或“<”),且c3__________1.0mol·L-1(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。
(11分)工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH="
-1025" KJ/mol
4NO(g)+6H2O (g) ΔH="
-1025" KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.5 |
0 |
|
第2min |
0.7 |
a |
0.1 |
|
第4min |
0.4 |
1.0 |
0.4 |
|
第6min |
0.4 |
1.0 |
0.4 |
|
第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数 (填“增大”、“减小”或“不变”)
(3)室温下,将第一次达到平衡时的混合气体通入水中,然后向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中,溶液中水的电离平衡将 (填“正向”“ 逆向”或“不”)移动,所滴加氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
(12分) 恒容密闭容器中,某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在前20min内用B的浓度变化来表示的平均速率
为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应在 20分钟内就达到
平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变
化表示),则达到平衡时υ3 υ1(填>、=、<=)
且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”、“放热”)。
(5) 800℃时,反应2A B+D的平衡常数= ,
实验2中达到平衡时A的转化率= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com