
题目列表(包括答案和解析)
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)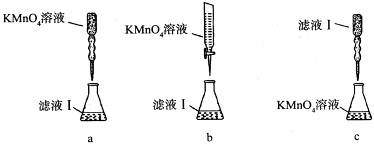
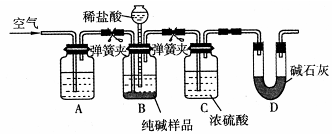
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。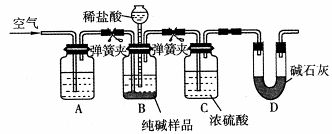
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。

 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
| ||
| ||
| 实验编号 | T/℃ | H2O2初始浓度/ mol?L-1 |
FeCl3初始浓度/ mol?L-1 |
| Ⅰ | 20 | 1.0 | 0 0 |
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 | 1.0 1.0 |
0.1 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com