
题目列表(包括答案和解析)
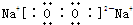
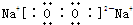
有A、B、C、D、E、五种短周期元素,A元素原子的最外层电子数比次外层多4个,B元素有3种同位素B1、B2、B3、,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E的气态氢化物水溶液显碱性而其最高价氧化物对应的水化物为强酸。下列说法正确的是
A.A和B可以形成原子个数比1:1的化合物
B.离子半径:D+ > C-
C.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
D.A、C、E三种元素气态氢化物的熔沸点都高于各自同主族元素气态氢化物的熔沸点
有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
⑴、写出由A、C、D三种元素形成的化合物的的电子式为 ▲ ,该化合物的化学键类型为 ▲ ,晶体类型为 ▲ 。
⑵、B的氢化物的沸点比同主族其他氢化物的沸点高,这可用 ▲ 来解释。
A.极性分子 B.氢键 C.共价键 D.离子键
⑶、D2E溶液呈 ▲ (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 ▲ 。
⑷、0.5L 0.1mol/L D的最高价氧化物的水化物与0.25L0.1 mol/LE的最高价氧化物的水化物反应放出2865 J的热量,该反应的热化学方程式为 ▲ 。
⑸、由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极的电极反应离子方程式为 ▲ 。
有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
⑴、写出由A、C、D三种元素形成的化合物的的电子式为 ▲ ,该化合物的化学键类型为 ▲ ,晶体类型为 ▲ 。
⑵、B的氢化物的沸点比同主族其他氢化物的沸点高,这可用 ▲ 来解释。
A.极性分子 B.氢键 C.共价键 D.离子键
⑶、D2E溶液呈 ▲ (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 ▲ 。
⑷、0.5L 0.1 mol/L D的最高价氧化物的水化物与0.25L0.1 mol/LE的最高价氧化物的水化物反应放出2865 J的热量,该反应的热化学方程式为 ▲ 。
⑸、由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极的电极反应离子方程式为 ▲ 。
有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
⑴、写出由A、C、D三种元素形成的化合物的的电子式为 ▲ ,该化合物的化学键类型为 ▲ ,晶体类型为 ▲ 。
⑵、B的氢化物的沸点比同主族其他氢化物的沸点高,这可用 ▲ 来解释。
A.极性分子 B.氢键 C.共价键 D.离子键
⑶、D2E溶液呈 ▲ (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 ▲ 。
⑷、0.5L 0.1 mol/L D的最高价氧化物的水化物与0.25L0.1 mol/LE的最高价氧化物的水化物反应放出2865 J的热量,该反应的热化学方程式为 ▲ 。
⑸、由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极的电极反应离子方程式为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com