
题目列表(包括答案和解析)
在100 mL含等物质的量HBr和H2SO3的溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol·L-1 B.0.18 mol·L-1
C.0.075 mol·L-1 D.0.08 mol·L-1
2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为_________ mol·(L·min)-1。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol·(L·min)-1;乙:v(Y)=2 mol·(L·min)-1;丙:v(Z)=4.5 mol·(L·min)-1;丁:v(X)=0.075 mol·(L·s)-1。若其他条件相同,温度不同,则温度由高到低的顺序是(填序号)____________。
(3)若向达到(1)的平衡体系中充入氮气,则平衡向___________(填“左”“右”或“不”)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向___________(填“左”“右”或“不”)移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较____________。
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为____________。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为____________。
(10分)2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
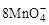 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
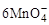 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______![]() +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
在100 mL含等物质的量HBr和H2SO3的溶液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol·L-1 B.0.0018 mol·L-1
C.0.075 mol·L-1 D.0.08 mol·L-1
(10分)2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
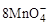 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
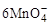 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______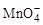 +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com