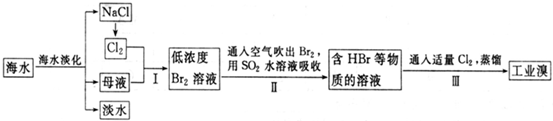
(2009?天津)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的一种方法:
蒸馏法、电渗析法、离子交换法等中的一种
蒸馏法、电渗析法、离子交换法等中的一种
.
(2)将NaCl溶液电解,在电解槽中可直接得到的产品H
2、
Cl2
Cl2
、
NaOH
NaOH
,或H
2、
NaClO
NaClO
.
(3)步骤Ⅰ中已获得Br
2,步骤Ⅱ中又将Br
2还原为Br
-,其目的为
富集溴元素
富集溴元素
.
(4)步骤Ⅱ用SO
2水溶液吸收Br
2,吸收率可达95%,有关反应的离子方程式为
SO2+Br2+2H2O═4H++2Br-+SO42-
SO2+Br2+2H2O═4H++2Br-+SO42-
,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是
强酸对设备的严重腐蚀
强酸对设备的严重腐蚀
.
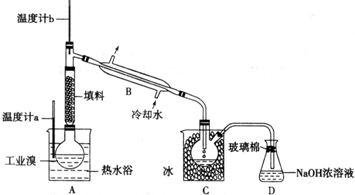
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br
2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,了解到如下装置:
请你参与分析讨论:
①图中仪器B的名称:
冷凝管
冷凝管
.
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
Br2腐蚀橡胶
Br2腐蚀橡胶
.
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
控制温度计b的温度,并收集59℃时的馏分
控制温度计b的温度,并收集59℃时的馏分
.
④C中液体产生颜色为
深红棕色
深红棕色
.为除去该产物中仍残留的少量Cl
2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
蒸馏
蒸馏
.


