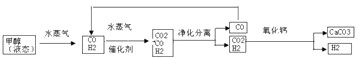
(2010?南通模拟)SO
2和NO
x的排放是造成酸雨的两大罪魁祸首.如图表示了某地区在1940~2002年间,空气中SO
2和NO
x含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据.

(1)结合上图数据,判断下列说法正确的是
BD
BD
.
A.在交通运输中排放的NO
x与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO
2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO
2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NO
x所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO
2的排放量明显地在逐年减少.请用化学方程式说明人类在为解决SO
2污染问题中所进行的一个反应过程:
CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
.
(3)汽车排放的尾气中含有未燃烧充分的C
mH
n、以及N
2、CO
2、NO、CO等.有人设计利用反应2NO+2CO?N
2+2CO
2 将有害的污染物转化为可参与大气循环的N
2和CO
2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol?L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol?L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
在上述条件下反应能够自发进行,则反应的△H
<
<
0(“>”、“<”、“=”).在该温度下,反应的平衡常数K=
5000
5000
.
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H
2O
2,充分反应后测得溶液的pH=3.62[c(H
+)=2.4×10
-4mol/L]),再向溶液中加入足量的Ba(OH)
2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g.若假设雨水的酸性仅由NO
x和SO
2的排放所致.请计算排放在空气中的NO
x和SO
2的物质的量之比接近于
1:1
1:1
.

 我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示
我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示