
某研究性学习小组设计并进行了如下实验.
(1)甲组同学用如图装置制取干燥纯净的二氧化碳气体.请回答下列问题:
①仪器X的名称是
长颈漏斗
长颈漏斗
.实验前,关闭活塞,向X中加入水使X中液面高于试管中的液面,一段时间后液面保持不变说明
A装置的气密性良好
A装置的气密性良好
.
②为除去CO
2中混有的HCl气体,B装置中盛放饱和NaHCO
3溶液,写出该反应的化学方程式
NaHCO3+HCl=NaCl+CO2↑+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
.
③要得到干燥的CO
2,C装置应盛放
浓硫酸
浓硫酸
(填试剂名称).
④请说明装置B、C中试剂不能交换的原因:
若将气体干燥后再通过饱和NaHCO3溶液,则又有水蒸气带出
若将气体干燥后再通过饱和NaHCO3溶液,则又有水蒸气带出
.
(2)乙组同学围绕CO还原CuO产生的红色固体是否一定是Cu进行探究:
【查阅资料】
①Cu
2O粉末呈红色.在酸性溶液中:Cu
2O+H
2SO
4=Cu+CuSO
4+H
2O
②在空气中高温灼烧时:Cu
2O稳定,而CuO将分解生成Cu
2O和O
2【提出猜想】
猜想Ⅰ:红色固体是Cu; 猜想Ⅱ:红色固体是Cu
2O; 猜想Ⅲ:红色固体是
Cu2O和Cu的混合物
Cu2O和Cu的混合物
.
【实验探究】
步骤Ⅰ:写出由Cu生成Cu
2O的化学方程式是
.
步骤Ⅱ:数据分析
(1)取一定质量的红色固体a g,在空气中高温灼烧,直到质量不再发生改变,称量所得固体质量为b g.
①若a=b,则猜想
II
II
成立;
②若b>a,则说明红色固体中一定含有
Cu
Cu
物质;
(2)另取少量红色固体投入稀硫酸中,充分反应后溶液呈蓝色.根据此现象,说明此红色固体中含有
Cu2O
Cu2O
,如果固体减少1.6g则原混合物中与稀硫酸发生反应的物质有
2.88
2.88
g.

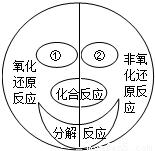 在反应前后有元素化合价发生变化的化学反应都属于氧化-还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化-还原反应的关系图.根据此图请回答下列问题:
在反应前后有元素化合价发生变化的化学反应都属于氧化-还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化-还原反应的关系图.根据此图请回答下列问题: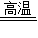 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑  CO2+2H2O
CO2+2H2O 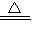 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑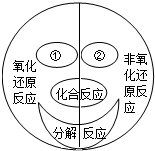 (2013?揭东县一模)在反应前后有元素化合价发生变化的化学反应都属于氧化-还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化-还原反应的关系图.根据此图请回答下列问题:
(2013?揭东县一模)在反应前后有元素化合价发生变化的化学反应都属于氧化-还原反应.如图是化学兴趣小组通过自主学习构建的四种基本反应类型与氧化-还原反应的关系图.根据此图请回答下列问题: 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.