
题目列表(包括答案和解析)
水在很多的反应中,起到极其重要的作用。根据下面水参与的反应,回答问题:
![]() ① 2F2+2H2O==4HF+O2 ②2Na2O2+2H2O== 4NaOH + O2↑
① 2F2+2H2O==4HF+O2 ②2Na2O2+2H2O== 4NaOH + O2↑
③2Na+2H2O==2NaOH+H2↑ ④2H2O====2H2↑+O2↑
(1)水只作氧化剂的是 ;(填写序号,下同)水只作还原剂的是 ;水既作氧化剂,又做还原剂的是 ;水既不是氧化剂,又不是还原剂的氧化还原反应是 。
(2)请标出下列反应的电子转移的方向和数目。
3Cl2 +6 NaOH=5NaCl + NaClO3 + 3H2O
(3)上述反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O若转移5mol电子,则所得氧化产物的物质的量为 mol。
水是组成生命体的重要化学物质,有关水的反应实例有很多。
(1) 在下列反应中,水仅被还原的是 。
A.Cl2+H2O=HCl+HClO B.2Na2O2 +2CO2=2Na2CO3 +O2
C.CaH2+2H2O=Ca(OH)2 +2H2↑ D.3Fe + 4H2O ![]() Fe3O4 + 4H2
Fe3O4 + 4H2
(2) 过氧化钠与水发生剧烈反应,反应时放出热量。写出此反应的化学方程式,并标出电子转移的方向和数目(用单线桥表示):
。
(3) 漂白粉常用于饮用水的杀菌消毒。漂白粉溶于水后,与空气中的CO2作用,能产生有漂白、杀菌作用的次氯酸。这一过程的化学反应方程式为 。
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+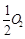 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。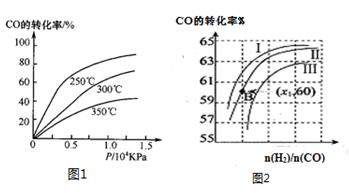
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ① CH3OH(g)。
CH3OH(g)。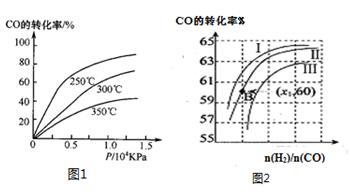
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为___________________________。
⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g) ΔH= +66.0 kJ·mol-1
W (s) + 2H2O (g) ΔH= +66.0 kJ·mol-1 W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。 WI4 (g)。下列说法正确的有________________。
WI4 (g)。下列说法正确的有________________。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com