
题目列表(包括答案和解析)
(15分)某有机化合物M,其分子式为AxByCz,且x+y+z=22。已知M放入水中即水解生成白色沉淀E和无色气体F。白色沉淀E不溶于氨水,能溶于氢氧化钠溶液。取0.1molM放入足量水中,能收集到9g气体F。将该气体在空气中完全燃烧,只生成26.4g二氧化碳和16.2g水,求:
(1)气体F的分子式。
(2)有机化合物M的分子式。
(3)写出M与过量的氢氧化钠溶液反应的化学方程式。
现代社会中铜在不同领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
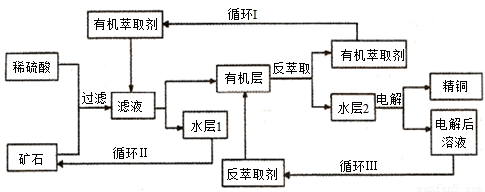
已知:反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生多步反应,除了发生Cu2O+2H+=Cu2++Cu+H2O和Fe2O3+6H+=2Fe3++3H2O反应外,其它反应的离子方程式为____________________________________________。
(2)检验滤液中是否含有Fe3+的方法是____________________________________________________。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐,若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式________ _____________。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 __________________。
(5)“循环Ⅲ”中反萃取剂的主要成分的化学式是________________。
(6) 黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O=6Cu+SO2↑。该反应中,_______ (填化学式)作还原剂,每生成1mol Cu,反应中转移电子的物质的量为____________。
已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L—1、0.0010 mol· L—1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L—1)的用量均为2 mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
| 实验编号 | 溶液褪色所需时间 t / min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.5 | 6.7 | 6.8 |
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
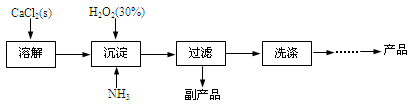
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
|
滴定次数 |
样品的质量/g |
KMnO4溶液的体积/mL |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
0.3000 |
1.02 |
24.04 |
|
2 |
0.3000 |
2.00 |
25.03 |
|
3 |
0.3000 |
0.20 |
23.24 |
表1. KMnO4标准溶液滴定数据
已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,某探究小组用KMnO4酸性溶液与H2C2O4(草酸)溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol· L—1、0.0010 mol· L—1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol· L—1)的用量均为2 mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
|
① |
298 |
0.5 |
0.010 |
a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和③探究温度对反应速率的影响; c. 实验①和④探究催化剂对反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
|
实验编号 |
溶液褪色所需时间 t / min |
||
|
第1次 |
第2次 |
第3次 |
|
|
① |
14.0 |
13.0 |
11.0 |
|
② |
6.5 |
6.7 |
6.8 |
则实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com