
题目列表(包括答案和解析)
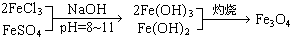
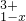 ?
?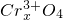 ],现有15.2g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为______.
],现有15.2g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为______.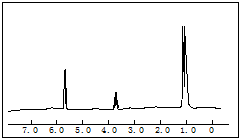 5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g.对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,根据上述信息,完成下列问题:
5.8g某含氧衍生物在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重5.4g,氢氧化钠溶液增重13.2g.对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条谱线,图是该物质的核磁共振氢谱,并且峰面积比分别为1:1:6,根据上述信息,完成下列问题:| A、+4 | B、+3 | C、+2 | D、+1 |
| A、1.8g氧-18气体的物质的量是0.1mol | B、0.1mol重氧气体的体积是2.24L | C、重氧气体的摩尔质量为36g | D、0.1mol重氧水所含中子数约是6.02×1023个 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com