
题目列表(包括答案和解析)
 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.| 53(w-m) |
| 22n |
| 53(w-m) |
| 22n |
(1)达到新的平衡时,混合气体的平均相对分子质量为____________。
(2)达到新的平衡时,混合气体的平均相对分子质量的变化值ΔMr=_____________。
(3)若混合气体的平均相对分子质量呈下列变化趋势,请确定m和n的关系:
①若混合气体的平均相对分子质量增大,则有______________。
②若混合气体的平均相对分子质量不变,则有______________。
③若混合气体的平均相对分子质量减小,则有______________。
(1)达到新的平衡时,混合气体的平均相对分子质量为___________。
(2)达到新的平衡时,混合气体平均相对分子质量的变化值Δ![]() =___________。
=___________。
(3)若混合气体的平均相对分子质量呈下列变化趋势,请确定m和n的关系。
①若混合气体的平均相对分子质量增大,则有______________________。
②若混合气体的平均相对分子质量不变,则有______________________。
③若混合气体的平均相对分子质量减小,则有______________________。
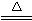 ?
?
图15-39
已知:2C![]() H
H![]() +(4x+y)CuO
+(4x+y)CuO![]() 2xCO2+(4x+y)Cu+yH2O?
2xCO2+(4x+y)Cu+yH2O?
(1)若只测定SO2气体,必须选用的装置是: (填装置序号,下同);若只测定混合气体中的CO2,必须选用的装置有 。?
(2)若四种气体分别依次通过③④①②⑤和③④⑤②①,是否都可测量出四种气体的质量分数? (填“能”或“不能”)。?
(3)若混合气体总质量为M g,分别依次通过③④①②⑤,实验②装置减少M1 g,⑤装置增重M2 g,则原混合气体中CH4的质量分数w (CH4) 。?
(4)若将混合气体中甲烷换成乙烯,其他不变(已知:3CH2![]() CH2+2KMnO4(稀)+4H2O
CH2+2KMnO4(稀)+4H2O![]() 3CH2OH—CH2OH+2KOH+2MnO2↓),设每次原混合气体取样均为M g,只选用装置中的③④⑤,能否测定混合气体中SO2的质量分数? (填“能”或“不能”)。如果能,请简要写出你的设计方案和结果:? ? 。??
3CH2OH—CH2OH+2KOH+2MnO2↓),设每次原混合气体取样均为M g,只选用装置中的③④⑤,能否测定混合气体中SO2的质量分数? (填“能”或“不能”)。如果能,请简要写出你的设计方案和结果:? ? 。??

图1-9
(A)在干燥管内填满碱石灰,总质量为m g;
(B)取n g样品装入广口瓶中;
(C)检验装置的气密性;
(D)缓缓鼓入空气数分钟,再称干燥管总质量为w g;
(E)关闭止水夹;
(F)打开止水夹;
(G)缓缓加入稀硫酸至不再产生气体为止;
(H)缓缓鼓入空气数分钟。
(1)正确的操作顺序是(填写序号):C→_______→F________→E_______→G________→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是________________;装置甲的作用是________________;装置乙的作用是________________。
(3)计算溶液中Na2CO3质量分数的计算式为_____________________________________。
(4)若去掉装置甲,测定结果会________;若去掉装置乙,测定结果会________。(填“偏大”“偏小”或“无影响”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com