
题目列表(包括答案和解析)
 工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质.某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置(说明:连接甲和乙的橡皮管有铁夹控制),先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.| 53(w-m) |
| 22n |
| 53(w-m) |
| 22n |
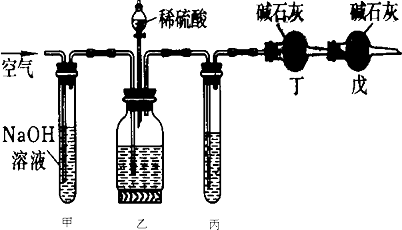

图1-9
(A)在干燥管内填满碱石灰,总质量为m g;
(B)取n g样品装入广口瓶中;
(C)检验装置的气密性;
(D)缓缓鼓入空气数分钟,再称干燥管总质量为w g;
(E)关闭止水夹;
(F)打开止水夹;
(G)缓缓加入稀硫酸至不再产生气体为止;
(H)缓缓鼓入空气数分钟。
(1)正确的操作顺序是(填写序号):C→_______→F________→E_______→G________→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是________________;装置甲的作用是________________;装置乙的作用是________________。
(3)计算溶液中Na2CO3质量分数的计算式为_____________________________________。
(4)若去掉装置甲,测定结果会________;若去掉装置乙,测定结果会________。(填“偏大”“偏小”或“无影响”)。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com