
题目列表(包括答案和解析)


金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石·玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO2—4的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO2—4的等电子体 。
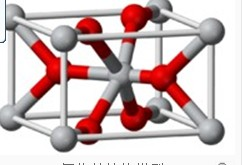
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示 。则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
。则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)

| ||
| ||
| 1173K |
| 1220K→1420K |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com