
题目列表(包括答案和解析)
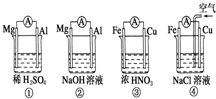
 分析如图所示的四个原电池装置,其中结论正确的是( )
分析如图所示的四个原电池装置,其中结论正确的是( )分析如图所示的四个原电池装置,其中结论正确的是 ( )

A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为6H2O+6e- ===6OH-+3H2↑
C.③中Fe作为负极,电极反应为Fe-2e-===Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-===H2↑
| A.①②中Mg作为负极,③④中Fe作为负极 |
| B.②中Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑ |
| C.③中Fe作为负极,电极反应为Fe-2e-═Fe2+ |
| D.④中Cu作为正极,电极反应式为2H++2e-═H2↑ |


| A.①②中Mg作为负极,③④中Fe作为负极 |
| B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑ |
| C.③中Fe作为负极,电极反应为Fe-2e-===Fe2+ |
| D.④中Cu作为正极,电极反应式为2H++2e-===H2↑ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com