
题目列表(包括答案和解析)
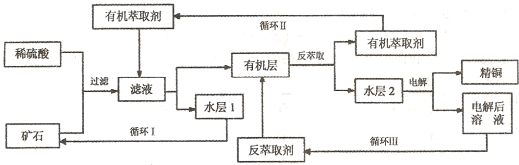
 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
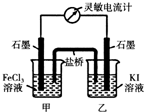
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是___________________________。
实验Ⅱ,取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是_______________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是_______________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_______________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是___________________________________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。
由上述实验得出的结论是________________________________________________________。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是______________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
(1)_______________________________________________________________;
(2)_______________________________________________________________。
某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是. ;
将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成。产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 ;
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是. 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com