
题目列表(包括答案和解析)
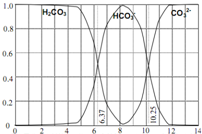 如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( )
如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( ) (2009?黄浦区二模)如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )
(2009?黄浦区二模)如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )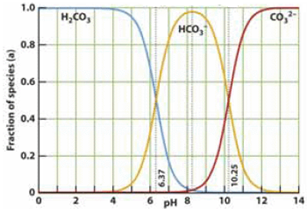 如图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
如图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是| A.pH=2时,H2CO3、HCO3-、CO32-共存 |
| B.在pH为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在 |
| D.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com