
题目列表(包括答案和解析)
| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
| c4(NO)?c6(H2O) |
| c4(NH3)?c5(O2) |
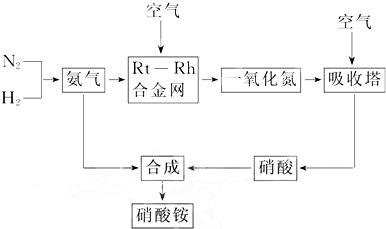
硝酸铵在工农业生产和国防中占有极为重要的位置,下面的流程图是硝酸铵的工业生产工艺过程.
(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.请回答
①在500℃、1.01×105 kPa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量小于92.4 kJ,理由:
②为有效提高氢气的转化率,实际生产中宜采取的措施有______.
A.降低压强 B.最适合催化剂活性的适当高温 C.增大压强 D.及时移出氨E.循环利用和不断补充氮气
(2)氨催化氧化的化学方程式为4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0.
该反应的化学平衡常数表达式K=______,当温度升高时,K值______(填“增大”“减小”或“无影响”).
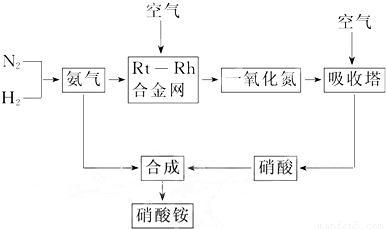
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程: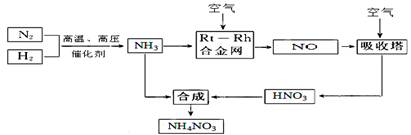
回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)="2.0" × 10-5 mol·L-1)。
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:

回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)=2.0 × 10-5 mol·L-1)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com