(1)将20g Ba(OH)
2?8H
2O晶体与10g NH
4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻片上.用玻璃棒迅速搅拌,一会儿可发现水结冰并将玻片粘在烧杯上.
①实验中玻璃棒的作用是
搅拌、混合反应物,促进反应进行
搅拌、混合反应物,促进反应进行
.
②写出有关反应的化学方程式
Ba(OH)2?8H2O+2NH4Cl=2NH3↑+BaCl2+10H2O
Ba(OH)2?8H2O+2NH4Cl=2NH3↑+BaCl2+10H2O
.
③通过
水结冰使玻片与烧杯粘在一起
水结冰使玻片与烧杯粘在一起
现象,说明该反应为
吸热
吸热
(填“吸热”或“放热”)反应;这是由于反应物的总能量
小于
小于
(填“小于”或“大于”)生成物的总能量.
(2)下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据:

分析上述数据,回答下列问题:
①该金属与稀硫酸进行的反应属于
ACDE
ACDE
A.放热反应 B.复分解反应 C.氧化还原反应 D.离子反应 E.置换反应
②实验1、2可得出的结论是
反应物浓度越大,反应速率越快
反应物浓度越大,反应速率越快
;实验3、4可得出的结论是
反应温度越高,反应速率越快
反应温度越高,反应速率越快
.
③如果将实验用的金属丝先浸入硫酸铜溶液一段时间后,再取出进行上述实验4,则反应需要的时间应
<
<
(填“>”或“<”)50s,你认为比较合理的解释是:
金属与置换出的铜构成原电池,加快了反应速率
金属与置换出的铜构成原电池,加快了反应速率
.
④若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁
强
强
(选填“强”或“弱”),铁在该原电池中作
正
正
极.

 CH3CH3↑+2CO2↑+H2↑+2KOH 现有下列衍变关系(A、B、C、D、E、F、G均为有机物)
CH3CH3↑+2CO2↑+H2↑+2KOH 现有下列衍变关系(A、B、C、D、E、F、G均为有机物)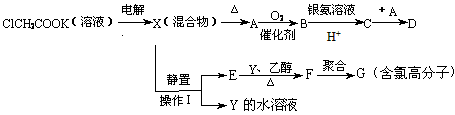

 如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.
如图所涉及的物质均为中学化学中的常见物质,其中C、D为气体单质,E是目前人类应用最广泛的金属,其余为化合物.它们存在如图转化关系,反应中生成的水及次要产物均已略去.